
治験業務支援 SMO
Clinical trial work support SMO
豊富な知識とノウハウを蓄積した
プロフェッショナルが支援します

弊社の治験支援事業は2003年に開始しました。
医療・福祉を通じて地域社会から頼られる存在となり、接するあらゆる人々に貢献することを目指すという経営理念のもとに、 医療機関の皆様、治験依頼者の皆様、そして治験に参加される患者様の全てにおいて信頼されるサポートを実施し、 未来の創薬を通じて、社会貢献につなげていきたいと考えております。
SMOとは
Site Management Organization の略で、治験施設支援機関のことをいいます。 医療機関と契約し、GCPに基づき適正で円滑な治験が実施できるように、煩雑な治験業務を支援します。
治験依頼者の皆様へ
当社は神奈川県央・横浜エリアを中心とした地域密着型のSMOです。
多岐にわたる領域の実績と、薬剤師のみで構成された「医療をみれるCRC」により、質の向上・治験のスピードアップに努めています。
CRCは当社薬局部門の調剤薬局にて実務経験を積んだ薬剤師のみで構成、治験事務局は専任の体制で支援し、あらゆる領域にも対応できるよう努めています。
また、臨床研究の支援も行っております。
当社の支援体制
- 入院外来、オンコール治験(24時間)対応可能(実績あり)
- 複数のEDCシステム経験あり
- 社内QCチェック制度あり
- 治験ライセンス保有CRC在籍

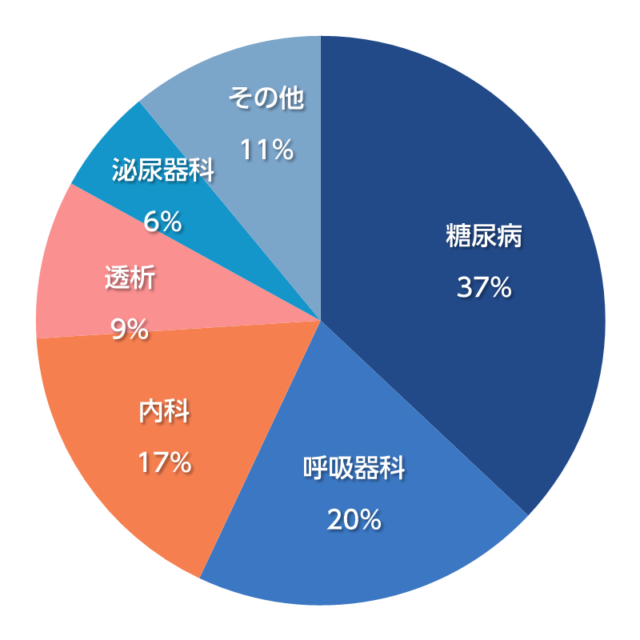
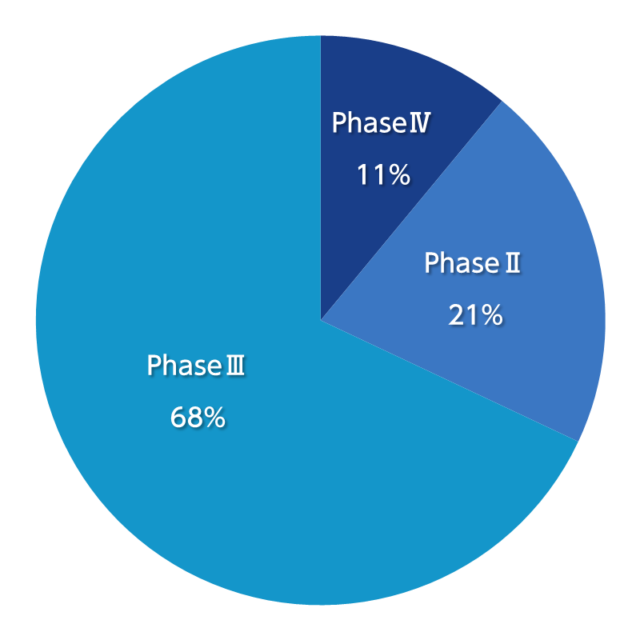
受託実績(2025年4月現在)
領域別の割合
主な受託疾患
- 過敏性大腸炎
- 過敏性腸症候群
- 過活動膀胱
- 慢性呼吸器疾患
- 異型肺炎
- 透析
- 気管支喘息
- 脳梗塞
- 外科
- 脂質異常症
- 腰部脊柱管狭窄症
- 肝疾患
- 肺炎
- 高血圧症
- COPD
- 糖尿病
- 糖尿病性末梢神経障害
- 変形性関節症
Phase別の場合
教育・認定制度
当社では、新人向けの導入研修および技能知識を向上させる継続研修を定めています。
治験支援事業に係わるCRC、SMAなど、基礎研修を終了し実務に配属された者もしくは、それ相応の能力があると認めた者に、社内認定証を発行しています。
社内認定後は、定期的に継続研修を実施し、スキルアップに努めています。
導入研修(2025/4/1)
医薬品医療機器等法、GCP関連法規、当該業務に関わる基礎教育(最低40時間以上)
1.治験とCRC
- 臨床試験概論(治験の位置付け・臨床研究との違い・歴史・ICH・環境・現状)
- 医薬品開発と臨床試験(非臨床試験から承認申請までの流れ、治験の用語)
- CRC/SMOの役割、位置づけ、SMOの業務内容
- CRCと治験事務局の役割と必要性
- 契約と治験費用
- 治験資料(治験薬概要書・治験実施計画書・同意文書・説明文書・症例報告書)
- 被験者の人権・安全・福祉の保護、インフォームドコンセントについて
- 治験実施の流れ
- 薬理作用と薬物動態
2.薬機法・GCP
- 医薬品医療機器等法と医薬品
- GCP各論
- 治験責任医師
- 実施医療機関の長
- 治験審査委員会
- 治験事務局
- 治験依頼者
- ヘルシンキ宣言
- 個人情報保護法
3.その他関連業務
- 必須文書の管理
- 安全性情報
- 補償と賠償
- 品質管理・品質保証
- データマネジメント業務と統計解析
実務に関わる業務についての教育(最低16時間以上)
4.CRCの業務内容
- SOPについて
- IRB参加
- プロトコールの理解
- 治験実施の流れを考える
- 治験実施のための各関連部署との連携
- スタートアップミーティング
- スクリーニング
- 被験者候補の選定補助(選択・除外基準等の確認)
- 同意説明補助
- 被験者登録支援
- 治験薬管理に関わる支援
- 治験担当医師との連携
- モニターとの連携
- 被験者対応について
- スケジュールの管理
- 被験者状況の確認(治験薬服薬状況、併用薬、他院他科受診の有無、有害事象の確認)
- 検査データ等原資料の管理
- 診察への同席、治験担当医師のサポート
- 検体の管理、検体会社への回収依頼等の対応
- 会計のサポート
- レセプトの確認
- 症例報告書の作成補助
- モニタリング、SDV
- 監査、規制当局の調査
5.社会人スキル・GCP
- プレゼンテーションスキル
- パソコンスキル
- ビジネスマナー
- コミュニケーションスキル
継続研修(年間40時間以上)
- 社内継続研修(GCP等関連法規、個人情報保護法、研究倫理、インシデント・アクシデント、コンプライアンス等について月1回 1時間程度)
- 併設する調剤薬局と合同の医薬品勉強会
- 日本SMO協会主催の継続研修
- シンポジウムへの参加
SOP改訂状況
治験支援業務を実施するにあたり、遵守すべき事項、基本方針および組織・責任体制を示す標準業務手順書(SOP)を作成し、適宜見直しや改訂を行っています。
標準業務手順書は、弊社における閲覧にて確認していただくことが可能です。
- 総則
- 治験の受託
- 治験事務局
- 治験審査委員会事務局
- 治験コーディネーター
- 記録の取扱い
- 品質管理・品質保証
- モニタリング・直接閲覧・監査
- セキュリティ
- 補償・賠償
- 教育・社内認定
- 重篤な有害事象の対応
- 不正行為防止の対応
医療機関の皆様へ
治験実施のメリット
従来、治験は大学病院等の大規模医療機関での実施が一般的でしたが、 診療所等の小規模医療機関での実施が近年増加しております。
しかし、小規模医療機関では、治験を実施するための経験や人員確保等により、 新GCPに則った業務遂行が困難な面もあります。こうした問題をSMO(治験施設支援機関)がサポートします。
メリット
- 将来の医療の発展や社会貢献になります。
- 治験に関わる院内スタッフ間で、綿密な連絡をとることが必要となりますので、院内の活性化や体制の強化が見込まれます。
- 治験依頼者より、実績に応じ、研究費が支払われます。
SMOの役割
- 治験では多くの書類や手続きが発生します。当社では専任の者が支援します。
- 通常診療とは異なり治験ならではの規定に従い実施する必要があります。これらを全面的に支援します。
治験事務局業務
- 治験依頼者と治験実施医療機関の間に入り、治験業務がスムーズに行われるよう、医療機関体制の整備、運営・進行管理などの様々な業務を専門スタッフがサポートします。
- 実施に際して、遵守すべきGCP(医薬品の臨床試験の実施の基準に関する省令)に関する知識を生かし、治験業務を行う医療機関に対して的確なアドバイスとサポートを行います。
- 施設の標準業務手順書(SOP)の作成支援
- 治験事務局および治験審査委員会(IRB)の運営支援
- 治験の進捗状況の管理
- モニタリング・直接閲覧(SDV)/監査・当局による調査対応の支援
- 治験関連書類の作成、保管支援

治験コーディネーター業務
- 治験実施医療機関において、治験責任医師・治験分担医師、治験協力者等の業務をサポートします。
- 治験に係わる各部門と連携をとり、治験業務が円滑に実施できるように調整を行います。一方で、治験依頼者との連絡窓口としても活躍します。
- 被験者候補の適格性調査支援(スクリーニング)
- 被験者候補への同意取得支援(インフォームド・コンセント)
- 症例登録支援
- 被験者対応
- 症例報告書の作成支援
- 治験実施計画書(プロトコール)遵守状況の確認
- GCP等の法規遵守状況の確認
- モニタリング・直接閲覧(SDV)・監査・当局による調査対応の支援
- 各関連部署との連絡

治験とは?
治験とは、国から薬として承認を得るための臨床試験のことをいいます。
新しい薬の候補を人が使用したときに、効き目や安全であるかを確認し、治験の結果は承認申請の際に、製薬会社が厚生労働省に提出します。
基礎研究「薬の候補の発見」(2~3年)
研究室で新しい薬になりそうな「くすりの種」を発見します。
非臨床研究「動物試験」(3~5年)
動物で、薬の作用や毒性、身体の中での代謝や排せつ状態など様々な試験を行います。
治験(3~7年)
大きく分けて3つの段階があります。
I
第Ⅰ相試験
健康な成人を対象に使用していただき、薬の作用や副作用、体内での動きを確認します。
II
第Ⅱ相試験
少数の患者さんに使用して主に薬の効果や副作用を調べます。
III
第Ⅲ相試験
多数の患者さんに使用して薬の効果や副作用を再確認します。
承認申請(1~2年)
試験結果を国に提出し、くすりとして認めてもらうために審査を受けます。
製造販売後調査(6ヶ月~10年)
くすりの販売後、実際の患者さんに使われた場合の有効性や安全性などを調べます。
治験実施の為のルール
治験の実施は、参加される患者様の「自由な意思」に基づき行われ、人権と安全性が最大限守られなければなりません。そのため、薬事法という法律と、厚生労働省が定めている「医薬品の臨床試験の実施の基準」(GCP)によって、厳格なルールが規定されています。
その中から主要な5項目を紹介します。
製薬企業が厚生労働省に治験実施計画書案を提出
動物実験や既に実施した治験成績の結果などを踏まえて治験実施計画書案を作成し、厚生労働省の審査を受けます。 厚生労働省は治験薬を使用しても安全性に問題ないかを確認し検討事項があれば指導します。 十分な検討の上、問題ないと判断された場合、治験実施が可能となります。
治験を行う病院の基準
治験を行う病院は、十分な設備があり専門の医師、看護師や薬剤師などが揃っていなければなりません。 また緊急時に直ちに適切な処置が行えるような体制を整えなければなりません。
治験審査委員会での治験実施の検討
治験審査委員会(IRB)は、治験の依頼を受けた病院とは利害関係のない人や医薬の専門外の人を加えて運営され、 治験の依頼を受けた病院が治験の実施に問題がないか、また参加される方の人権と安全性に問題がないかを審査します。
インフォームド・コンセント
治験を担当する医師が、治験の参加を希望される患者様に治験の内容を説明する際、 文書にて説明を行います。文書で同意をいただかなければなりません。
プライバシーの保護
治験関係者には、治験に参加される方のプライバシー・個人情報に関して守秘義務が課せられており、違反した場合には、法により罰せられます。
